Stikstofmonoxide
Stikstofmonoxide
|
Stikstofmonoxide
|
||||||
| Structuurformule en molecuulmodel | ||||||
 |
||||||
|
Structuurformule van stikstofmonoxide
|
||||||
| Algemeen | ||||||
| Molecuulformule (uitleg) |
NO | |||||
| IUPAC-naam | stikstofmonoxide | |||||
| Andere namen | RCRA P076 | |||||
| Molmassa | 30,0061 g/mol | |||||
| SMILES |
[N]=O
|
|||||
| InChI |
1S/NO/c1-2
|
|||||
| CAS-nummer | 10102-43-9 | |||||
| EG-nummer | 233-271-0 | |||||
| PubChem | 145068 | |||||
| Beschrijving | Kleurloos gas | |||||
| Vergelijkbaar met | stikstofoxide, salpeterzuur | |||||
| Waarschuwingen en veiligheidsmaatregelen | ||||||
|
||||||
| H-zinnen | H270 - H314 - H331 | |||||
| EUH-zinnen | geen | |||||
| P-zinnen | P220 - P261 - P280 - P305+P351+P338 - P310 | |||||
| Carcinogeen | ja | |||||
| Omgang | Gas niet inademen, contact vermijden | |||||
| Opslag | Indien in gasfles: niet boven 52°C laten uitkomen; verwijderd houden van hitte, vonken en open vlammen | |||||
| VN-nummer | 1660 | |||||
| ADR-klasse | Gevarenklasse 2.3 | |||||
| MAC-waarde | 25 ppm 30 mg/m³ |
|||||
| Fysische eigenschappen | ||||||
| Aggregatietoestand | gasvormig | |||||
| Kleur | kleurloos | |||||
| Smeltpunt | −163,6 °C | |||||
| Kookpunt | −151,7 °C | |||||
| Oplosbaarheid in water | 0,067 g/l | |||||
| Slecht oplosbaar in | water | |||||
| Thermodynamische eigenschappen | ||||||
| ΔfH |
90 kJ/mol | |||||
| ΔfH |
87,7 kJ/mol | |||||
| S |
211 J/mol·K | |||||
| Waar mogelijk zijn SI-eenheden gebruikt. Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||||
|
||||||
Stikstofmonoxide is een anorganische verbinding met als brutoformule NO. De stof komt voor als een kleurloos gas. Het ontstaat onder andere bij verbrandingsprocessen in auto's en elektriciteitscentrales.
Inhoud
Synthese[bewerken]
Op industriële schaal wordt stikstofmonoxide bereid door de oxidatie van ammoniak bij 750 tot 900 °C, in aanwezigheid van platina als katalysator:
Een alternatieve, maar veel energieverslindender methode, is het Birkeland-Eydeproces, waarbij gebruik wordt gemaakt van een vlamboog. Dit gebeurt in een sterk magnetisch veld zodat de vlamboog wordt afgevlakt tot een schijf. Het plasma in de schijf heeft een temperatuur van meer dan 3000 °C. Men blaast dan lucht doorheen de schijf, waar een klein gedeelte van de zuurstof en stikstof in de lucht reageert tot stikstofmonoxide:
In het laboratorium wordt het gas bereid door reductie van kaliumnitriet met kaliumjodide in zuur milieu:
In plaats van kaliumjodide kan ook kaliumhexacyanoferraat(II) gebruikt worden:
Een eenvoudige methode is de reactie van natriumnitriet met zwavelzuur:
Eigenschappen en reacties[bewerken]
Als stikstofmonoxide wordt opgelost in water, ontstaat een oplossing van het zeer onstabiele salpeterigzuur (HNO2):
In de lucht reageert stikstofmonoxide bij hoge concentraties snel met zuurstofgas tot stikstofdioxide (NO2):
Deze reactie treedt op wanneer bijvoorbeeld koper wordt opgelost in salpeterzuur. In eerste instantie wordt hierbij stikstofmonoxide gevormd:
Door oxidatie tot stikstofdioxiden komen bij deze reactie typische bruine nitreuze dampen vrij.
Stikstofmonoxide draagt bij aan luchtverontreiniging. Het draagt bij aan verzuring van regenwater (door de reactie met water tot salpeterigzuur, alsook door oxidatie tot salpeterzuur) en aan de afbraak van de ozonlaag.
Stikstofmonoxide komt voor als een vrij radicaal, dat zeer gemakkelijk en heftig reageert met de halogenen tot de overeenkomstige nitrosylverbindingen. Een voorbeeld is de vorming van nitrosylchloride:
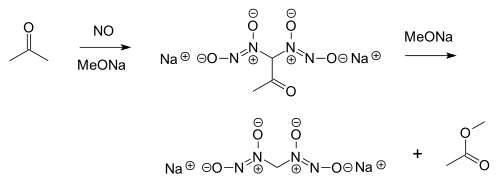
Stikstofmonoxide reageert met aceton, in aanwezigheid van een alkoxide, tot een nitrosohydroxylamine:[1]
Deze reactie staat bekend als de Traube-reactie, naar de ontdekker van de reactie, de Duitse scheikundige Wilhelm Traube.
Rol van stikstofmonoxide in het lichaam[bewerken]
In de jaren '80 van de 20e eeuw werd ontdekt dat stikstofmonoxide een belangrijke intercellulaire signaalstof is. In het centrale zenuwstelsel is stikstofmonoxide een neurotransmitter, en in het autonome zenuwstelsel is het een neurotransmitter die gladde spiercellen ontspant, onder andere in het maag-darmkanaal en in de penis.
In de bloedvaten wordt stikstofmonoxide door de endotheelcellen aangemaakt als vasodilaterende stof. In 1987 werd deze endothelium-derived relaxing factor geïdentificeerd als stikstofmonoxide.[2] Stikstofmonoxide wordt door zogenoemde stikstofmonoxidesynthase-enzymen aangemaakt uit het aminozuur arginine.
Sommige immuuncellen produceren grote hoeveelheden stikstofmonoxide die toxisch zijn voor de onmiddellijke omgeving.
Europese registratrie als medisch inhalatiegas[bewerken]
Stikstofmonoxide is Europeees geregistreerd als inhalatiegas,[3] in een concentratie van 400 en 800 ppm. De indicaties zijn:
1. Behandeling van pasgeborenen met pulmonale hypertensie om de zuurstofvoorziening te verbeteren.
2. Toepassing bij kinderen tot 17 jaar, met als doel het selectief verlagen van de arteriële druk en verbetering van de rechterventrikelfunctie en het verbeteren van de zuurstofopname.
Nobelprijs en molecule van het jaar[bewerken]
In 1992 werd NO door het blad Nature uitgeroepen tot molecule van het jaar. In 1998 werd de Nobelprijs voor de Fysiologie of Geneeskunde uitgereikt aan Ferid Murad, Robert F. Furchgott en Louis Ignarro voor hun ontdekking van de biologische signaalfunctie van stikstofmonoxide.
Externe links[bewerken]
- (en) MSDS van stikstofmonoxide
- (en) Gegevens van Stikstofmonoxide in de GESTIS-stoffendatabank van het Duitse Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung (IFA) (JavaScript vereist)
Bronnen, noten en/of referenties
|
| Neurotransmitters |
|---|
|
acetylcholine (ACh) · adrenaline · anandamide · aspartaat (Asp) · β-lipoproteïne · bombesine · cholecystokinine (CCK) · corticotropine (ACTH) · dopamine (DA) · dynorfine · endorfine · enkefaline · γ-aminoboterzuur (GABA) · glutamaat (Glu) · glycine (Gly) · histamine · leumorfine · motiline · neurofysine I · neurofysine II · neurokinine A · neurokinine B · neuropeptide A · neuropeptide γ · neuropeptide Y · noradrenaline · peptide YY · serotonine (5-HT) · stikstofoxide (NO) · substantie P |
Licentie: eigendomslicentie







![{\displaystyle \mathrm {KNO_{2}\ +\ K_{4}[Fe(CN)_{6}]\ +\ H_{2}SO_{4}\ \longrightarrow \ NO\ +\ K_{3}[Fe(CN)_{6}]\ +\ K_{2}SO_{4}\ +\ H_{2}O} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/6d277945f01f436cbc4740dda5eace42db768f46)